2025年10年8日,我院陆华松研究员团队与厦门大学薛玉花教授课题组合作在国际知名期刊《Nature Chemical Biology》在线发表题为“Stabilization of AFF1 by PARylation ensures transcriptional restart after DNA damage”的研究论文。该研究首次发现,PARP1通过一种被称为“PARSTA”的“意面”机制催化转录延伸因子AFF1发生ADP核糖基化修饰,从而维持AFF1在DNA损伤压力下的蛋白稳定性,促进细胞在损伤修复完成后实现高效的转录重启。该发现揭示了PARP1在DNA损伤应答过程中的全新功能,为深入理解基因组稳定性维持与转录应答调控之间的联系提供了重要理论依据。我院已毕业学生付欢怡、朱文萱、李呈瑜以及与我院联合培养的厦门大学朱飞凤博士为论文共同第一作者;陆华松研究员和薛玉花教授为论文共同通讯作者。

真核细胞中由RNA聚合酶II(Pol II)介导的基因转录是基因表达调控的核心环节。其中,超级转录延伸复合体(Super Elongation Complex,SEC)能显著增强Pol II的转录延伸活性,由支架蛋白AFF1/4与转录因子P-TEFb、ELL1/2 、ENL 和 AF9等组成。已有研究表明,SEC复合体在肿瘤发生、细胞命运决定及压力应答等过程中发挥关键作用,但其在DNA损伤应答中的具体机制仍不清楚。
细胞在遭受DNA损伤时会经历显著的基因表达重塑。一方面,DNA修复相关基因需迅速激活以修复损伤;另一方面,整体转录活动呈现“快速抑制—重新启动”的双相动态。目前,尽管已有研究揭示了DNA损伤下转录抑制的多种机制,但修复完成后的转录重启机制仍缺乏深入理解。而PARP1作为维持基因组完整性的关键因子,是否参与该过程,尚未被证实。
在本论文中,研究人员以DNA损伤后染色质滞留蛋白为切入点,通过蛋白质组学质谱技术鉴定到一系列在DNA损伤条件下与染色质结合增强的蛋白,结果分析表明这些蛋白主要富集于DNA损伤修复与转录通路。另一方面,考虑到PARP1作为DNA损伤应答中的关键信号因子,研究人员在分析过程中进一步整合了既往研究中获得的PARP1蛋白互作组数据,比对结果发现SEC复合体的核心支架蛋白AFF1不仅是PARP1的互作因子,其在染色质上的滞留水平也在DNA损伤后显著增强。随后的研究证实,AFF1的601-900结构域可以被PARP1直接招募至损伤位点并发生多聚ADP核糖基化修饰。分子机制研究发现,AFF1的ADP核糖基化修饰并不影响SEC复合体的组装或AFF1的乙酰化,但能显著削弱其与E3连接酶Siah1的结合,从而抑制Siah1介导的泛素化修饰,使其逃逸泛素化-蛋白酶体降解途径,维持了AFF1在DNA损伤压力下的蛋白稳定性。不同于以往ADP核糖基化促进泛素化的“PARdU”模型,本研究发现的PARSTA(意面)机制则能够通过ADP核糖基化抑制AFF1泛素化降解,从而实现蛋白稳定化。
功能研究进一步表明,PARSTA机制稳定的AFF1对于DNA损伤后的转录重启至关重要。当AFF1缺失时,细胞的转录恢复、DNA损伤修复,及细胞存活能量显著降低。最后,研究人员发现在产生放疗耐受的肿瘤细胞中,PARP1-AFF1信号轴活性显著提高,为肿瘤细胞在放疗后的转录快速重启提供了强大后盾。抑制PARP1活性或者敲低AFF1能够显著增强肿瘤细胞的放疗敏感性,增强对肿瘤细胞的杀伤作用。
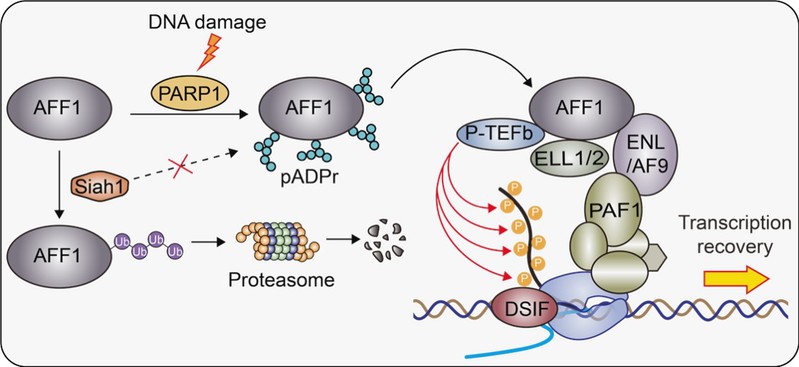
图1:PARP1-AFF1信号轴通过PARSTA机制介导DNA损伤后的转录重启
综上,该工作揭示了DNA损伤后PARP1-AFF1信号轴在转录重启中的分子机制及重要功能,不仅为研究PARP1及ADP核糖基化修饰在翻译后修饰中的交互作用和维持蛋白稳定性中的多样性功能提供了全新的视角,更为靶向放疗抵抗的癌症治疗提供了新的理论依据与潜在靶点。该研究的开展得到了本院黄俊、张龙、焦会朋等老师和共享服务平台的大力支持,研究经费主要来自于国家自然科学基金面上基金和浙江省杰出青年基金延续项目等。陆华松课题组聚焦于无膜凝聚体与基因表达在基因组稳定性维持、压力应答、肿瘤发生和细胞衰老等过程中的功能研究,实验室目前有多个方向的课题正在展开,欢迎感兴趣的同学联系与加入。
实验室主页:/syssy_40763/list.htm
原文链接:https://www.nature.com/articles/s41589-025-02045-5